[2025-01-27] (Accès libre) L’IMDRF (International Medical Device Regulators Forum) a publié, le 27 janvier 2025, un nouveau document traitant des considérations relatives à la caractérisation des logiciels de dispositifs médicaux (DM) et des risques spécifiques aux logiciels.
Contexte et objectifs du guide
Une version provisoire du texte avait fait l’objet d’une consultation l’année dernière, et d’un article du réseau DMEXPERTS.
L’IMDRF nous livre donc la version finale du document, désormais intitulé : « Characterization Considerations for Medical Device Software and Software Specific Risk ». Le groupe de travail « Software as a Medical Device » de l’IMDRF en est toujours responsable.
Les objectifs de ce document de 47 pages restent les mêmes, à savoir :
- souligner l’importance d’une caractérisation complète des logiciels de DM, afin d’éclairer d’autres activités liées à leur cycle de vie, notamment l’évaluation des risques et la catégorisation/classification des dispositifs ;
- établir les principales caractéristiques et un vocabulaire commun pour la caractérisation des logiciels de DM ;
- identifier les éléments fondamentaux d’une déclaration d’utilisation prévue pour les logiciels de DM ;
- établir des liens entre les caractéristiques de caractérisation du logiciel de DM et les risques ; et
- fournir des informations à prendre en considération lors de l’identification et de l’évaluation des risques spécifiques aux logiciels de DM.
Quelles évolutions pour cette version finale ?
Dans l’ensemble, la version finale de 2025 reste semblable à la version provisoire de 2024 soumise à consultation. Le texte est rehaussé de nombreuses précisions, de termes plus adéquats ou de mises en forme. Parmi toutes les modifications apportées, nous citerons :
- Un changement dans le titre du document, qui s’appelait précédemment « Medical Device Software: Considerations for Device and Risk Characterization » (le lien fonctionne toujours si vous souhaitez comparer les deux versions) ;
- Dans le chapitre 3 sur les références :
- Ajout de 4 normes ou rapports techniques :
- ANSI/AAMI SW96:2023 – Standard For Medical Device Security – Security Risk Management For Device Manufacturers,
- IEC/TR 80002-1:2009 – Logiciel de dispositifs médicaux — Partie 1: Guide sur l’application de l’ISO 14971 pour les logiciels de dispositifs médicaux,
- IEC 81001-5-1:2021 – Sécurité, efficacité et sûreté des logiciels de santé et des systèmes TI de santé — Partie 5-1: Sûreté — Activités du cycle de vie du produit,
- IEC 82304-1:2016 – Logiciels de santé — Partie 1: Exigences générales pour la sécurité des produits
- Ajout du document l’IMRDF : « Software as a Medical Device : Possible Framework for Risk Categorization and Corresponding Considerations ». L’IMDRF précise d’ailleurs bien que le document actuel n’a pas pour objectif de remplacer celui sur les « logiciels en tant que dispositifs médicaux » (Software as Medical Device, SaMD). Il en étend effectivement le périmètre, les SaMD étant une sous-catégorie des logiciels de DM.
- Ajout de 4 normes ou rapports techniques :
- Une précision dans le titre du chapitre 4, qui passe de « Device Characterization Considerations » à « Medical Device Software Characterization Considerations », ainsi qu’un léger changement dans le titre du 4.2 ;
- Ajout de la figure 1 dans le 4.1, synthétisant ce qu’il faut considérer pour la caractérisation des logiciels DM :
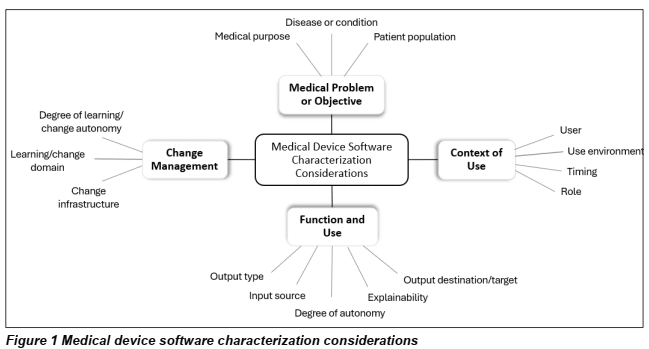
- L’annexe D est renommée « Appendix D: Examples of Linking Characterization Features and Risk ». Les tableaux et les textes y sont d’ailleurs réarrangés pour être plus lisibles ;
- et bien d’autres encore…
Nous ne pourrons évidemment pas détailler l’ensemble des modifications dans cet article. Nous ne pouvons donc que vous inciter à vous y plonger si le sujet vous concerne.
Conclusion
Ce texte rejoint donc la (longue) liste des documents interprétatifs pour les logiciels utilisés avec ou en tant que DM. L’IMDRF annonce explicitement qu’il n’a pas vertu à remplacer les lignes directrices (guidances) existantes dans d’autres réglementations. Les fabricants concernés pourront cependant l’utiliser comme source d’inspiration pour caractériser les logiciels associés à leur DM (ou leur SaMD), et identifier les risques logiciels spécifiques en lien avec cette caractérisation.
Article rédigé par Christophe Saillet, membre du réseau DMEXPERTS.
