[2024-03-08] (Accès libre) La Commission européenne vient de publier une mise à jour de la liste des normes harmonisées à l’appui du règlement (UE) 2017/745 relatif aux dispositifs médicaux (RDM).
La décision d’exécution (UE) 2024/815 vient donc amender la décision d’exécution (UE) 2021/1182, qui n’avait pas été modifiée depuis le 5 juillet 2023. Comme indiqué dans le titre de la dernière décision d’exécution, les nouvelles normes harmonisées sont relatives aux « gants médicaux non réutilisables, à l’évaluation biologique des dispositifs médicaux, à la stérilisation des produits de santé, aux emballages des dispositifs médicaux stérilisés au stade terminal et au traitement de produits de soins de santé ».
Le tableau suivant présente le détail des normes nouvellement harmonisées au RDM :
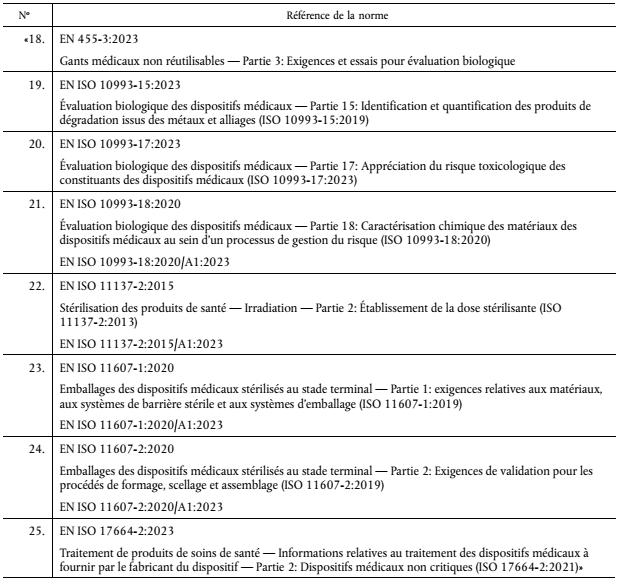
Aucune norme figurant dans la version antérieure de la liste n’a été modifiée ou retirée.
La liste complète des normes harmonisées au RDM est téléchargeable sur le site de la Commission européenne, au format PDF (uniquement en anglais) ou au format MS Excel (en plusieurs langues, dont le français), selon vos préférences.
Article rédigé par Christophe SAILLET, membre du réseau DM Experts.
