[2022-07-04] (Accès libre) Toutes les échéances pour l’application du règlement (UE) 2017/746 (RDMDIV) ont été modifiées avec la publication du règlement (UE) 2022/112 du 25 janvier 2022 (voir notre article précédent).
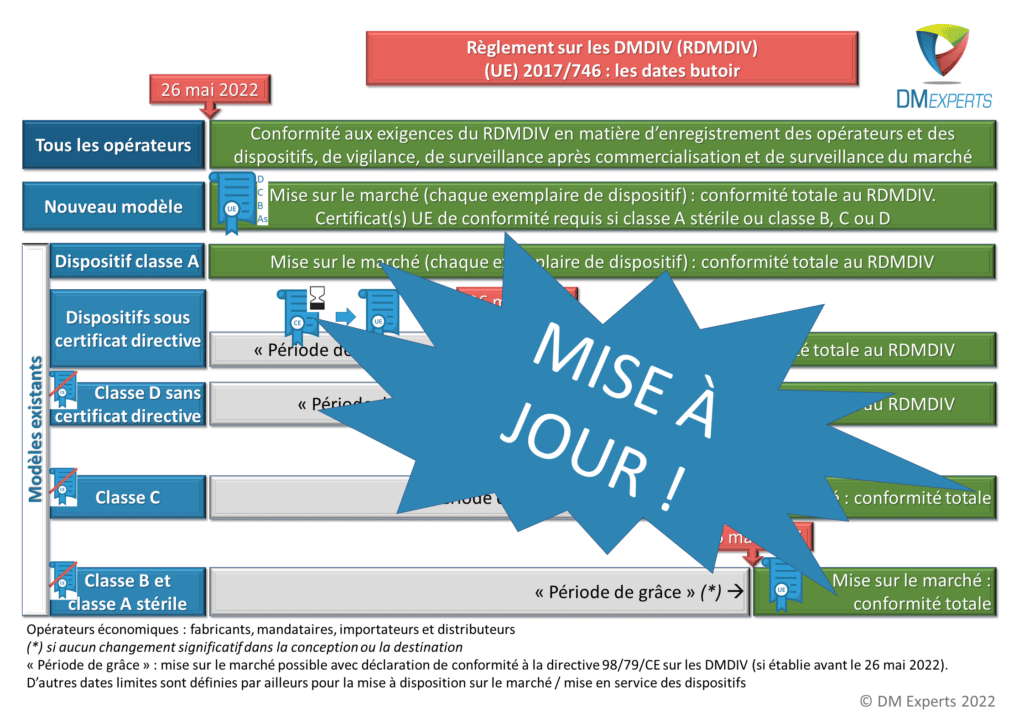
Pour vous aider à vous y retrouver en fonction de vos certificats et de la classe de vos dispositifs, nous avons mis à jour notre infographie, que vous pouvez télécharger gratuitement sur notre site à cette adresse. Profitez-en !
Article rédigé par Denys Durand-Viel, Président de DM Experts SAS
