[2025-12-17] (Accès libre) Le MDCG (groupe de coordination en matière de dispositifs médicaux) a mis à jour, le 17 décembre 2025, sa prise de position pour les calendriers de mise en œuvre du ‘Master UDI-DI’ pour les lentilles de contact, les montures de lunettes, les verres de lunettes et les lunettes de lecture prémontées.
Quelques rappels
Le ‘Master UDI-DI’ est un identifiant unique utilisé pour regrouper certains dispositifs hautement individualisés. Ces dispositifs partagent la même combinaison de paramètres de conception.
On y retrouve donc notamment les montures de lunettes, les verres de lunettes et les lunettes de lecture prémontées, tels que définis dans le règlement délégué (UE) 2025/1920. Pour rappel, un guide publié en novembre 2025 décrit la mise en place du ‘Master UDI-DI’ pour ces dispositifs. Nous avons traité le sujet dans un article précédent du réseau.
Cet identifiant sera nécessaire pour enregistrer ces dispositifs dans la base de données européenne des dispositifs médicaux (Eudamed). Il fait office d’UDI-DI (UDI = identifiant unique du dispositif, DI = partie identifiant du dispositif), comme défini dans la partie C de l’annexe VI du règlement (UE) 2017/745.
Révision de la prise de position
Pour en revenir à la prise de position, il s’agit d’un texte de 6 pages, toujours intitulé « MDCG 2025-7 Rev. 1 -MDCG Position Paper : Timelines of the implementation of ‘Master UDI-DI’ to contact lenses and spectacle frames, spectacle lenses and ready-to-wear reading spectacles ». La prise de position est passée en révision 1 en décembre 2025.
Dans un de nos précédents articles, nous vous avions présenté ce guide lors de sa première publication. Il avait été rédigé avant la publication au Journal officiel de l’Union européenne des dernières évolutions réglementaires pour les lentilles, d’une part, et pour les verres, montures et lunettes de lecture prémontées, d’autre part. Il s’agit donc d’un alignement sur la réglementation, en particulier sur les échéances finales.
La révision 1 apporte ainsi les modifications suivantes :
- pages 3 et 4 : insertion de références au règlement délégué (UE) 2025/788 et au règlement délégué (UE) 2025/1920 ;
- page 4 : insertion d’une référence à l’avis sur la fonctionnalité et à la date d’utilisation obligatoire à compter du 28 mai 2026, et suppression de la référence au « dernier calendrier Eudamed disponible » ;
- page 4 : mise à jour de la date d’applicabilité du règlement délégué (UE) 2025/1920 ;
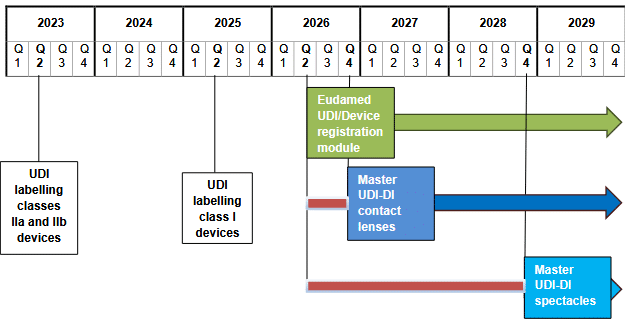
- page 5 : mise à jour du diagramme représentant les dates de référence et les délais ;
- page 6 : mise à jour de la date possible d’utilisation obligatoire du module de vigilance et de surveillance après commercialisation dans Eudamed ;
- page 6 : insertion de références aux documents d’orientation MDCG 2024-14 Rev.1 et MDCG 2025-8.
Les dates importantes
La prise de position rappelle plusieurs dates futures majeures à retenir :
- Utilisation obligatoire du module d’enregistrement ‘UDI/Device’ d’Eudamed dans le cas général : 28 mai 2026 ;
- Mise en œuvre du ‘Master UDI-DI’ pour les lentilles de contact : 9 novembre 2026 ;
- Mise en œuvre du ‘Master UDI-DI’ pour les montures de lunettes, les verres de lunettes et les lunettes de lecture prémontées : 1ᵉʳ novembre 2028.
Conclusion
En conclusion, les fabricants de lentilles de contact, de montures de lunettes, de verres de lunettes et de lunettes de lecture prémontées (‘ready-to-wear reading spectacles’ ou ‘ready readers’) sont vivement encouragés à attribuer des ‘Master UDI-DI’ avant les dates d’application obligatoires.
Cependant, les solutions concrètes dépendent des entités d’attribution des UDI (‘Unique Device Identifier’ ou Identifiant unique des dispositifs) désignées par la Commission européenne : GS1, HIBCC et IFA (ICCBBA opérant dans la traçabilité des produits d’origine humaine). Elles n’ont pas encore toutes publié de spécifications pour les ‘Master UDI-DI’ des différents produits concernés. Retrouvez ces entités et d’autres informations sur la page de la Commission consacrée à l’UDI.
Article rédigé par Christophe Saillet, membre du réseau DMEXPERTS.
