[2024-02-05] (Accès libre) Comme nous l’avions annoncé dans un article précédent, le Snitem, en partenariat avec la banque publique d’investissement (Bpifrance), a présenté le 5 février 2024, devant plus d’une centaine de participants, les résultats de l’étude intitulée « Panorama et analyse qualitative de la filière industrielle des dispositifs médicaux en France ».
Un livret de 36 pages, édité pour l’occasion, a été distribué aux personnes présentes. Vous pouvez le consulter ou le télécharger au format PDF sur le site du Snitem. Vous pouvez également revoir l’enregistrement vidéo des présentations :
- Allocution d’ouverture, par Laurence Comte-Arassus, Présidente du Snitem
- Présentation du panorama 2023 par Dominique Carlac’h, Présidente de D&Consultants
- Présentation des actions mises en place par le gouvernement pour soutenir la filière, par :
- Roxane Spinardi, Coordinatrice interministérielle du plan dispositifs médicaux de France 2023 – DGE et
- Charles-Emmanuel Barthelemy, Adjoint à la Sous-Directrice Politique des Produits de santé et qualité Pratiques – DGS
- Table ronde, avec :
- Bernard Celli, Vice-Président en charge des produits et prestations – Comité Économique des Produits de Santé (CEPS)
- Cyrille Fleury, Chairman & Chief Executive Officer – Menix Group
- Thierry Herbreteau, Président – Peters Surgical
- Arnaud Vincent, Managing Director – Eurazeo
- Bilan 2023 financement des dispositifs médicaux France 2030, avec :
- Fatima Heniche, Responsable sectorielle dispositifs médicaux numériques, Direction de l’innovation – Bpifrance
- Peggy Rematier, Responsable sectorielle dispositifs médicaux, Direction de l’innovation – Bpifrance
Beaucoup de chiffres ont été présentés, que l’on peut différemment interpréter selon que l’on a l’habitude de voir le verre à moitié vide ou à moitié plein. Voici quelques exemples :
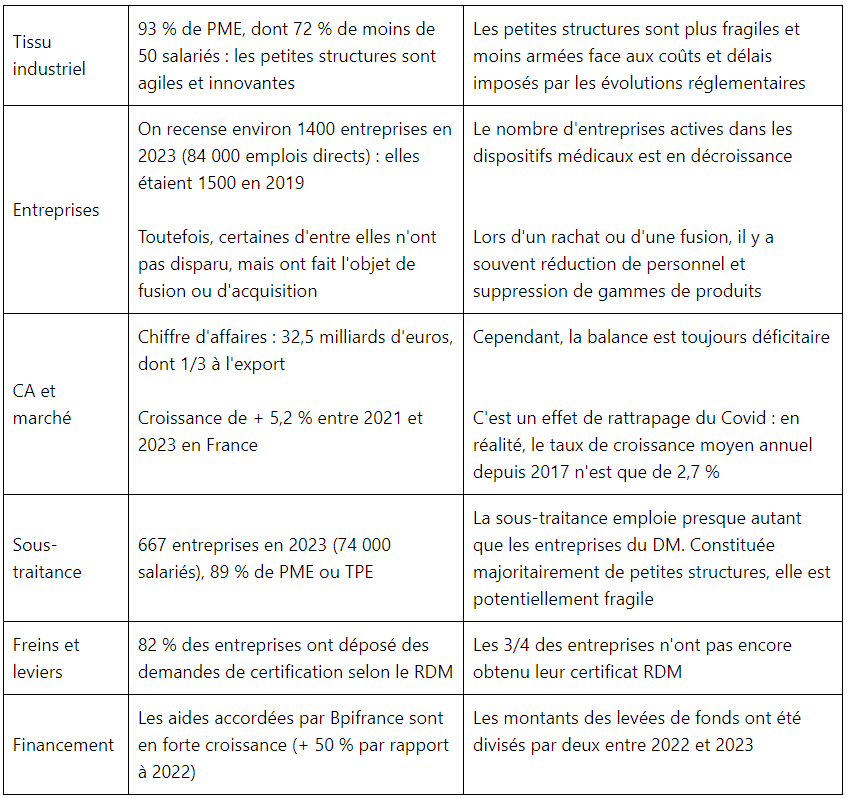
Les actions de la France pour soutenir la filière et assouplir le cadre réglementaire ont été rappelées par la DGE et la DGS.
Lors de la table ronde, Peters Surgical et SERF ont tous deux exposé les efforts considérables qui ont été requis pour se mettre à niveau du règlement (UE) 2017/745 (RDM), avec un impact négatif sur les activités de Recherche et Développement, et des décisions inéluctables de suppressions de gammes pour les produits qui présentent un retour sur investissement insuffisant (décision volontaire de renoncer à 20 % du chiffre d’affaires chez Peters Surgical). Les coûts de la certification ont été multipliés par 3 ou plus, et les durées pour aboutir aux nouveaux certificats se sont considérablement allongées.
Cette situation a des répercussions sur les stratégies de lancement de nouveaux produits, qui s’orientent préférentiellement vers les États-Unis et l’Australie plutôt que l’Europe, en raison d’un accès au marché beaucoup plus rapide.
On notera toutefois la taille des entreprises qui ont participé à la table ronde :
– Peters Surgical : 800 personnes,
– SERF (groupe Menix) : 172 employés, CA : 50 M€.
On peut s’étonner du choix de ces intervenants, qui sont bien loin de représenter les 93 % de PME et TPE du secteur : si les deux sociétés ont réussi à surmonter les difficultés rencontrées, il y a lieu d’être bien moins optimiste pour les structures de taille plus modeste, qui n’ont pas les reins aussi solides pour absorber l’impact des changements réglementaires. Selon Thierry Herbreteau, les disparitions d’entreprises vont continuer, et la situation actuelle, avec 3/4 de ces entreprises sans certificat RDM, est une bombe à retardement.
Article rédigé par Denys Durand-Viel, Président de DM Experts SAS
