[2024-12-02] (Accès libre) L’organisme notifié (ON) GMED a consacré sa newsletter n° 17 de décembre 2024 aux laboratoires de référence de l’Union européenne (EURL) pour les dispositifs médicaux de diagnostic in vitro (DMDIV) de classe D.
Contexte
Pour mémoire, le recours aux EURL est une nouvelle exigence du règlement (UE) 2017/746 relatif aux DMDIV (RDMDIV). Dans ce contexte, les EURL ont pour objectif de :
- vérifier les performances alléguées par le fabricant et la conformité des DMDIV classe D ;
- réaliser les essais appropriés sur les échantillons de DMDIV fabriqués de classe D ou de lots de DMDIV classe D.
Désignation des EURL et catégories couvertes
À ce jour, seules quatre des huit catégories de DMDIV de classe D sont couvertes par des EURL. La figure ci-dessus, tirée de la publication, présente les catégories couvertes et celles restantes :
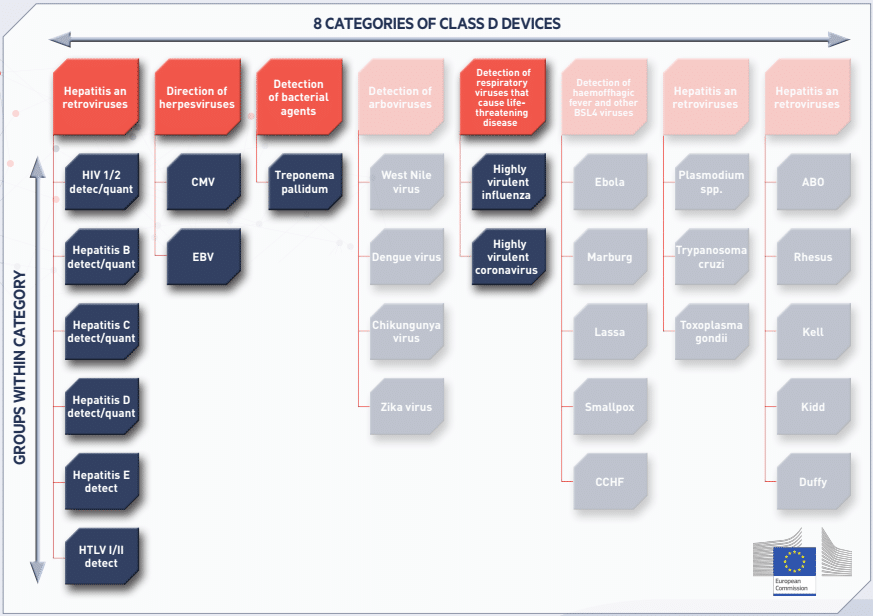
Cinq EURL ont donc été désignés en ce sens par la Commission européenne via le règlement d’exécution (UE) 2023/2713 (voir l’article du réseau à ce sujet). Ce règlement est entré en application au 1ᵉʳ octobre 2024. La Commission européenne a par ailleurs lancé un second appel à candidature pour les quatre catégories non couvertes.
Mise en application du règlement (UE) 2023/2713
Un des intérêts de cette newsletter réside dans le graphique présenté ci-dessous. Pour la légende, « PV » y représente la vérification des performances et « BT » la réalisation des essais sur les lots de production.
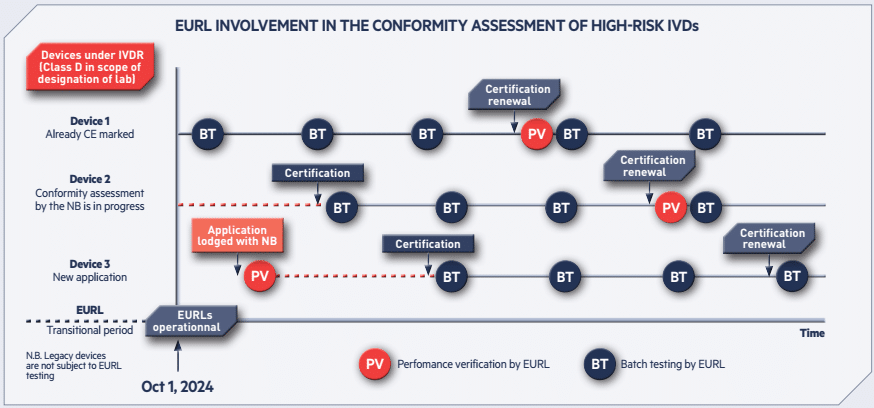
Il synthétise l’implication des EURL (pour les catégories couvertes) en fonction de la place du DMDIV (de classe D) dans le processus de certification selon le RDMDIV. Trois cas de figure existent :
- DMDIV déjà couvert par un certificat RDMDIV au 1ᵉʳ octobre 2024 (« Device 1 ») ;
- DMDIV en cours de certification avant le 1ᵉʳ octobre 2024 (« Device 2 ») ;
- DMDIV dont la demande formelle est déposée après le 1ᵉʳ octobre 2024 (« Device 3 »).
Cela fait d’ailleurs écho à un article précédent du réseau. Il y était question de la mise à jour du MDCG 2021-4 rev.1 sur les dispositions transitoires pour ces DMDIV, justement en rapport avec la publication du règlement (UE) 2023/2713.
Conclusion
Si cette newsletter du GMED n’apporte pas réellement de nouvelles informations, elle a l’avantage de synthétiser l’essentiel sous une forme condensée, visuelle et majoritairement en français. Elle appelle également les fabricants concernés à suivre les évolutions concernant les EURL sur la page dédiée de la Commission européenne.
Article rédigé par Christophe Saillet, membre du réseau DMEXPERTS.
